5 / 2016 / vol. 5
Kosmetologia Estetyczna
468
N
artykuł naukowy
biochemia
zależy od oddziaływania pomiędzy keratynocytami a mela-
nocytami. Nieprawidłowości zarówno na etapie melanocy-
tofagocytozy, jak i transportu barwnika mogą prowadzić do
dyschromii, czyli trudnych do wyleczenia, a co za tym idzie
– uciążliwych i długotrwałych plam pigmentacyjnych.
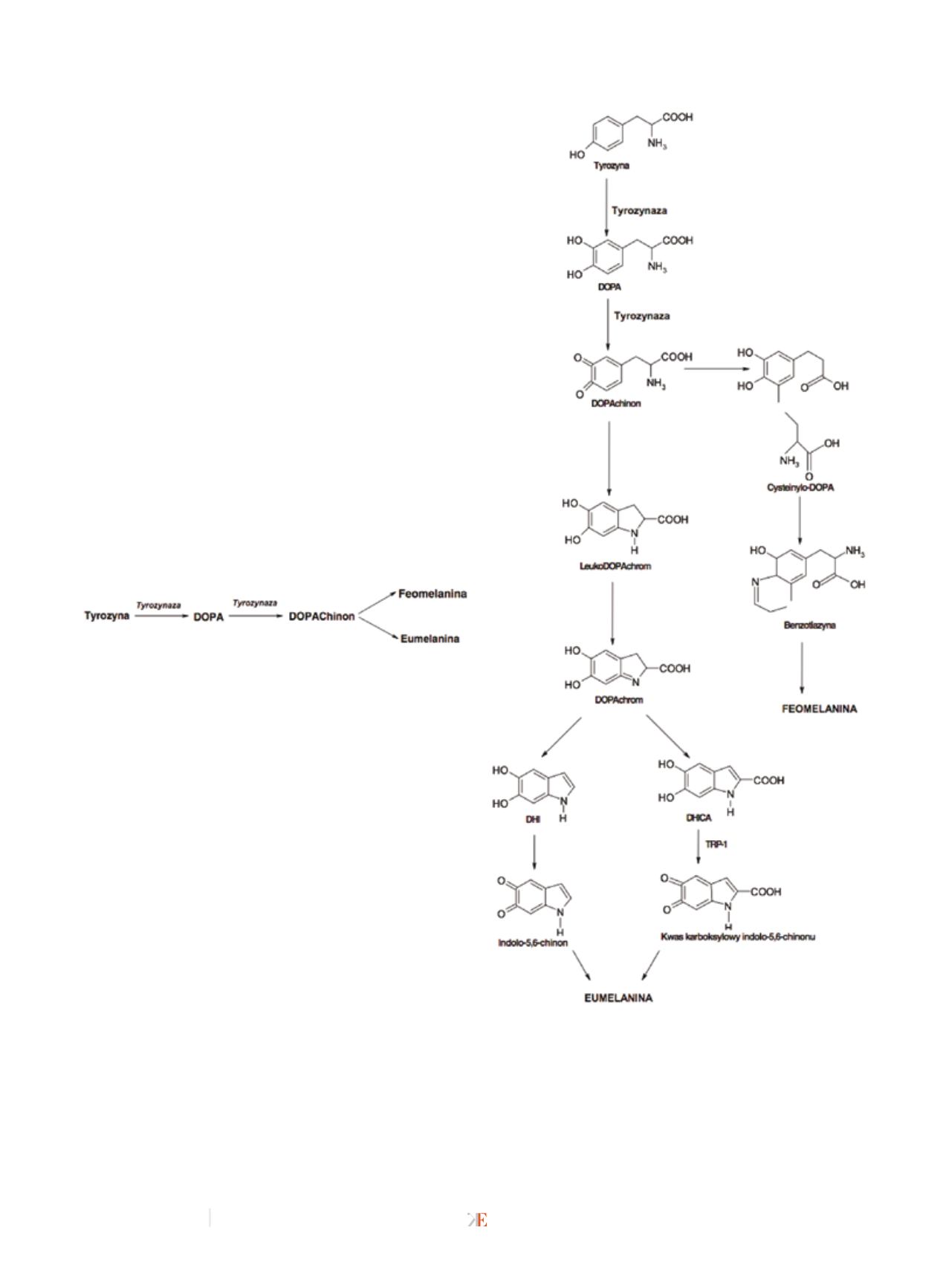
Melanina będąca produktem przemiany aminokwasu L-fe-
nyloalaniny do L-tyrozyny ulega przekształceniu do dihydrok-
syfenyloalaniny, w skrócie L-DOPA. Obecność w organizmie
aminokwasów zawierających siarkę determinuje zajście proce-
su polimeryzacji z cysteiną i/lub glutationem, w wyniku czego
powstaje feomelanina – czerwono-żółty barwnik. Brak grup
tiolowych prowadzi do utleniania L-DOPA do L-DOPA-chino-
nu, z którego powstaje eumelanina – brązowo-żółty barwnik.
Najistotniejszym enzymem w procesie melanogenezy jest ty-
rozynaza (rys. 1). Etap początkowy, na którym wykazuje swoją
aktywność, decyduje o szybkości całego procesu syntezy mela-
niny. Warunkuje przekształcenie L-tyrozyny do L-DOPA, a na-
stępnie jej utlenianie do L-dopachinonu. Aberracje występujące
w procesie melanogenezy powodują powstawanie hiperpig-
mentacji w skórze uprzednio niezmienionej. Dotyczy to liczby
aktywnych komórek barwnikowych, jak i ich rozmiarów oraz
nieproporcjonalnego gromadzenia się pigmentu w wyniku nie-
prawidłowości w wytwarzaniu barwnika [2, 3].
Rys. 1
Ogólny schemat melanogenezy
Nieco bliższe przyjrzenie się roli, jaką odgrywa tyrozynaza,
stanowi istotę zrozumienia mechanizmu działania substancji
aktywnych stosowanych w preparatach leczniczych. Tyrozy-
naza, zwana również oksydazą tyrozynową, zapoczątkowuje
cykl reakcji w procesie melanogenezy. Jest to glikoproteina
transportowana do melanosomów, gdzie uczestniczy w bio-
syntezie melaniny [4].
Tyrozynaza zbudowana jest z trzech obszarów, które odpowie-
dzialne są za działanie, jakiewykazuje. CzęśćN-końcowa, wktórej
znajdują się dwa atomymiedzi, odpowiedzialna jest za aktywność
katalityczną oksydazy DOPA. Umiejscowiona jest wewnątrz
melanosomu. W zależności od stopnia utlenienia i obecności czą-
steczki tlenu wyróżnić można: oksytotyrozynę, gdzie atomy mie-
dzi na +II stopniu utlenienia przyłączają cząsteczkę tlenu z wy-
tworzeniemmostka nadtlenkowego; met-tyrozynazę, gdzie Cu(II)
jest centrum koordynacji z przyłączonymi ligandami zawierają-
cymi grupę hydroksylową; deoksytyrozynazę zawierającą dwa
atomy miedzi na +I stopniu utlenienia [5]. Domena C-końcowa
koordynuje wewnątrzkomórkowy transport enzymu. Znajduje
się tutaj charakterystyczna sekwencja: kwas glutaminowy-X-X-
glutamina-prolina-leucyna-leucyna (gdzie X oznacza dowolny
aminokwas), która decyduje o aktywności i lokalizacji tyrozynazy,
a zlokalizowana jest w cytoplazmie melanocytu. Trzecia domena
– transbłonowa zespala N- i C-końcowe części [6].
W procesie melanogenezy uczestniczą również dwa inne en-
zymy: TRP1 (
tyrosinase related protein 1
) oraz TRP2 (
tyrosinase
related protein
2). Są to białka związane z tyrozynazą 1 (oksy-
daza kwasu 5,6-dihydroksyindolo-2-karboksylowego) i tauto-
meraza DOPAchromu. Wykazują one strukturalne podobień-
stwo do tyrozynazy oraz lokalizację – znajdują się w błonie
Rys. 2
Szlak melanogenezy


