Basic HTML Version
38
vol. 1 / 1 / 2012 / Kosmetologia Estetyczna
Tabela 1
Wyniki obliczeń metodą DFT B3LYP/6-31G(d,p)
Numer
związku
Budowa związku
Energia (E)
[kcal/mol]
ΔE
[kcal/
mol]*
1
Metyloglioksal
E= -167640
2
Metyloglioksal + 1 H2O E= -215598 ΔE= -24
3
Metyloglioksal + 2 H2O E= -263560 ΔE= -26
4
Metyloglioksal + 3 H2O E= -311526 ΔE= -28
5
Metyloglioksal + 4 H2O E= -359495 ΔE= -30
6
Metyloglioksal + 5 H2O E= -407464 ΔE= -31
Woda H2O
E= -47933
ΔE= E
(kompleksu) – [E metyloglioksal) -
E
odpowiedniej liczby cząsteczek
wody] podzielone przez odpowiednią liczbę cząsteczek wody
Tabela 1 przedstawia wyniki obliczeń energii oddzia-
ływania MGO z rosnącą liczbą cząsteczek wody, po prze-
liczeniu na jedną cząsteczkę wody dodanej. Efekt doda-
wania kolejnych cząsteczek wody rośnie. ΔE przyjmuje
coraz większe wartości ujemne – dołączając 1 cząsteczkę
wody, obniżamy energię układu o 24,4 kcal/mol (przyłą-
czenie cząsteczki wody do tlenu grupy aldehydowej daje
mniejszą energię oddziaływania -10,4 kcal/mol). Dołącza-
jąc 2 cząsteczki wody, otrzymujemy wartość ΔE, w przeli-
czeniu na jedną cząsteczkę wody równą -26,3 kcal/mol; do-
łączając 4 cząsteczki wody, obniżamy energię o -30,0 kcal/
mol. Największy spadek energii występuje po dołączeniu
5 cząsteczek wody; ΔE = -31,1 kcal/mol. Wskazuje to na
tak zwany efekt kooperatywny w działaniu cząsteczek
wody. Każda kolejna cząsteczka wody wnosi więcej zysku
energii niż poprzednia. Małe nieregularności mogą wy-
nikać z faktu, że cząsteczki wody przyłączają się do coraz
mniej aktywnych centrów i mogą pojawić się przeszkody
steryczne. Energia przyłączania cząsteczki wody do MGO
waha się od 24 do 31 kcal/mol, przy czym w otoczeniu
wielu cząsteczek wody jest bliższa około 30 kcal/mol
Szczegółowe wyniki obliczeń dla witaminy C i kom-
pleksów witaminy C z MGO przedstawiono w tabeli 2
Cząsteczki wody i MGO są dodawane w pozycji C3-OH
( jedna z diolowych grup OH). Pozostałe cząsteczki wody
mają taką samą konfigurację w każdym przykładzie – dla
kompleksu i dla witaminy C.
DE’ jest w tym przypadku bezpośrednim efektem te-
modynamicznym przyłączenia jednej cząsteczki wody
lub MGO do uwodnionej cząsteczki witaminy C, w pozy-
cji C3-OH. Przedstawiono kilka wariantów organizacji
danej ilości cząsteczek wody. Obserwowany rozrzut wy-
ników pozwala określić prawdopodobną dokładność uzy-
skanych rezultatów. Biorąc pod uwagę rozrzut wynikły
prawdopodobnie z różnic w oddziaływaniu cząsteczek
wody pomiędzy sobą i możliwych efektów sterycznych
(porównaj rys. 2 i 3), nie jesteśmy w stanie dokładnie
określić, na ile dodatkowe cząsteczki wody stabilizują
kompleksy witaminy C z MGO i z wodą. Możliwe jest na-
E= -645307 kcal/mol E= -645315 kcal/mol
E= -693282 kcal/mol E= -741248 kcal/mol
E=789210 kcal/mol E=- 837180 kcal/mol
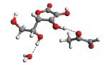
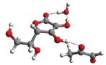
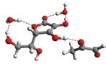
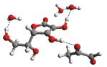
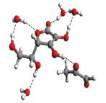
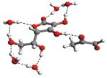
Rys. 6
Przykładowe struktury kompleksu witamina C – MGO – n-cząsteczek wody
Tabela 2
Wyniki obliczenia energii wiązania między cząsteczką MGO a odpo-
wiednio uwodnioną witaminą C oraz między uwodnioną witaminą C a dodaną
cząsteczką wody
Rodzaj kompleksu
Energia
kompleksu
[kcal/mol]
Energia wit
C. z liczbą n
cząst. wody
[kcal/mol]
ΔE’
[kcal/
mol]*
1
Wit. C-MGO
-597345
-429695
-11
2
Wit. C-MGO + 1 H2O -645307
-477658
-11
Wit. C-MGO + 1 H2O -645312
-477663
-11
Wit. C-MGO + 1 H2O -645314
-477665
-10
Wit. C-MGO + 1 H2O -645315
-477665
-10
3
Wit. C-MGO + 2 H2O -6932745
-525625
-11
Wit. C-MGO + 2 H2O -693277
-525628
-10
Wit. C-MGO + 2 H2O -693280
-525631
-10
Wit. C-MGO + 2 H2O -693282
-525633
-10
Wit.C-MGO + 2 H2O -693282
-525633
-10
4
Wit. C-MGO + 3 H2O 741243
-573593
-11
Wit. C-MGO + 3 H2O -741245
-573595
-11
Wit. C-MGO + 3 H2O -741248
-573598
-10
5
Wit. C-MGO + 4 H2O -789210
-621561
-11
6
Wit. C-MGO + 5 H2O -837180
-669531
-11
7
Wit. C- H2O
-477665
-429695
-36
8
Wit. C- H2O + 1 H2O -525627
-477658
-36
8
Wit. C- H2O + 1 H2O -525636
-477663
-40
Wit. C- H2O + 1 H2O -525636
-477665
-33
Wit. C- H2O + 1 H2O -525632
-477665
-33
9
Wit. C- H2O + 2 H2O -573595
-525625
-36
Wit. C- H2O + 2 H2O -573598
-525628
-37
Wit. C- H2O + 2 H2O -573602
-525631
-37
Wit. C- H2O + 2 H2O -573603
-525633
-37
Wit. C- H2O + 2 H2O -573603
-525633
-37
10
Wit. C- H2O + 3 H2O -621569
-573593
-42
Wit. C- H2O + 3 H2O -621564
-573595
-35
Wit. C- H2O + 3 H2O -621569
-573598
-37
11
Wit. C- H2O + 4 H2O -669531
-621561
-37
12
Wit. C- H2O + 5 H2O -717501
-669531
-37
W przypadku kompleksu wit. C-MGO
*ΔE’= E(kompleksu) – [E (metyloglioksal) - E (wit. C z odpowiednią liczbą
cząsteczek wody)], gdzie E metyloglioksalu=-167640 kcal/mol
W przypadku kompleksu wit. C + H
2
O
*ΔE’= E(kompleksu) – [E (wody) - E (wit. C z odpowiednią liczbą cząste-
czek wody)], gdzie E wody=-47934 kcal/mol

