Basic HTML Version




37
Kosmetologia Estetyczna / 2012 / 1 / vol. 1
W procesach metabolicznych ulega degradacji w reakcjach
utleniania i redukcji z udziałem atomów tlenu [3]. Utwo-
rzenie stosunkowo silnych wiązań wodorowych z udzia-
łem tych atomów mogłoby zwiększyć stabilność MGO.
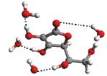
Witamina C (kwas L-askorbinowy) jest
γ
-laktonem
kwasu 2,3-dehydro-L-gulonowego, nazywanego rów-
nież kwasem L-treo-hekso-2-enonowym (rys. 2). Jego
wzór strukturalny został ustalony w 1933 r. Najbardziej
charakterystycznym fragmentem cząsteczki kwasu
L-askorbinowego jest ugrupowanie endiolowe. Jest to
ugrupowanie, które zawiera dwie grupy wodorotlenowe,
znajdujące się przy podwójnym wiązaniu. Warunkuje
ono właściwości redukujące związku oraz jego kwasowy
charakter (pKa1 = 4.0) [10]. Proces degradacji witaminy
C przebiega z udziałem tych grup [11]. Ich reaktywność
może być pomniejszona poprzez udział w wiązaniu wo-
dorowym. Obserwując wzór strukturalny cząsteczki
witaminy C, można zauważyć, że ma on kilkanaście cen-
trów zdolnych do tworzenia wiązań wodorowych. Dlatego
pierwszym krokiem w dyskusji jest próba ustalenia naj-
bardziej stabilnej struktury kompleksu. Przeprowadzo-
ne obliczenia dla wielu różnych struktur pozwoliły na
ustalenie, że najbardziej prawdopodobna jest struktura
przedstawiona na rys. 3a. Metyloglioksal przyjmuje kon-
figurację trans. Obliczenia pokazują, że jest ona bardziej
stabilna o ponad 8 kcal/mol i że tworzenie różnych struk-
tur kompleksu nie zmienia tego faktu.
Odejmując wartości energii kompleksu od sumy energii
składników, można oszacować wartość energii oddziały-
wania, jaka może być wykorzystana do oceny względnej
stabilności różnych form kompleksów. Przyłączenie MGO
do endiolowej grupy OH daje większą stabilność komplek-
su (∆ dla struktury 3a wynosi -9,48 kcal/mol, gdy dla 3b)
-8,09 kcal/mol). Wyniki te można przyjąć wstępnie jako
dowód wzajemnego oddziaływania obu czynnych biolo-
gicznie substancji i potwierdzenia hipotezy, że synergizm
oddziaływania obu związków wynika z ich wzajemnej
stabilizacji poprzez utworzenie kompleksu z wiązaniem
wodorowym. Rozpatrywane oddziaływania przebiegają
w środowisku płynów fizjologicznych, a więc w roztwo-
rach wodnych. Wpływ środowiska symulowano, prowa-
dząc obliczenia dla struktur z rosnącą liczbą cząsteczek
wody – od 1 do 5. W celu przeanalizowania wartości ener-
gii poddano analizie energię poszczególnych składników
kompleksu dla różnej lokalizacji cząsteczek wody i porów-
nano z tak samo uwodnionymi cząsteczkami kompleksu.
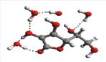
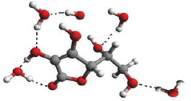
Przykładowe struktury kompleksów MGO z wodą przed-
stawiono na rys. 4, a kompleksów z witaminą C na rys. 5.
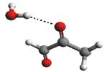
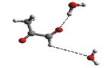
Rys. 1
Cząsteczka trans
metyloglioksalu
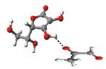
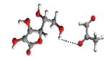
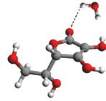
Rys. 3
Kompleksy metyloglioksalu – witamina C:
a)
o najniższej energii,
b)
z metyloglioksalem przyłączonym do alkoholowej grupy OH
E= - 215598 kcal/mol E=-263560 kcal/mol
E= -263560 kcal/mol E=-359495 kcal/mol
E=-407465 kcal/mol E=- 407431kcal/mo
l
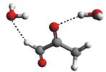
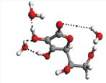
Rys. 4
Przykładowe struktury kompleksów MGO z różną liczbą przyłączonych
cząsteczek wody
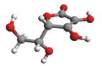
Rys. 2
Kwas L-askorbinowy
(witamina C)
E=-477664 kcal/mol E= - 573601 kcal/mol
E= - 621391 kcal/mol E=- 669470 kcal/mol
E=-669199 kcal/mol
Rys. 5
Struktury wybranych kompleksów witaminy C z rosnącą liczbą przyłą-
czonych cząsteczek wody

